
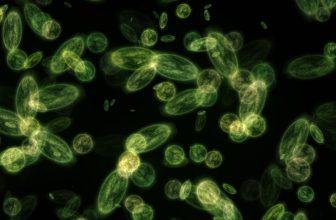
Les diatomées sont des organismes unicellulaires délicats qui ont un chloroplaste jaune-brun qui leur permet de faire la photosynthèse. Leurs parois cellulaires sont faites de silice presque comme une maison de verre. La construction de la paroi cellulaire, appelée frustule, se compose de deux valves qui s’emboîtent comme un petit pilulier.
La couleur du chloroplaste est jaune-brun au lieu du vert que nous connaissons chez d’autres créatures qui utilisent la lumière comme source d’énergie.
Il existe deux groupes différents de diatomées, les pennées en forme de stylo et les centriques en forme de cylindre. En eau douce, la plupart des diatomées que vous verrez sont de type penné.
Où trouve-t-on des diatomées ?
A la fin de l’hiver, elles sont plus nombreuses en eau douce. Elles couvriront les surfaces de plantes aquatiques ou les poteaux et les bordures en bois des étangs. Si vous aimez les étudier, vous pouvez gratter la croissance brune avec un morceau de plastique plat. Vous pouvez également utiliser une éponge.
Pour les espèces vivant en liberté (plancton), un filet à plancton spécial à mailles fines est très utile.

De nombreuses espèces de diatomées restent connectées après la division des cellules. EIles forment des colonies, de longues chaînes. Parfois, seules les pointes sont connectées et forment un motif en zigzag.
Les cellules des diatomées sont des sujets idéaux pour l’étude au microscope. Elles présentent des motifs complexes de perforations très fines et elles ont souvent toutes sortes d’ornements.
La meilleure façon de rendre visibles les belles structures du frustule est de supprimer le contenu de la cellule. Le peroxyde d’hydrogène peut être utilisé pour cela. Mais il est également possible de trouver des frustules vides de diatomées mortes.
Les pores extrêmement fins du frustule de certaines espèces de diatomées sont utilisés pour tester le pouvoir de résolution de la lentille d’un microscope.
La locomotion des diatomées
Les diatomées pennées, qui se sont développées plus tard dans l’histoire de la Terre, sont capables de se déplacer en glissant lentement dans le sens de la longueur de la cellule. Le mécanisme n’est pas encore bien compris, mais il semble qu’à travers la fente le long de la cellule (le raphé) de minuscules microfibrilles dépassent. Avec ceux-ci, elles peuvent se déplacer sur une surface. Sur l’image de la diatomée nettoyée au-dessus du raphé, on peut voir la fine ligne horizontale centrale.
Il existe deux groupes différents de diatomées, les pennées en forme de stylo et les centriques en forme plus ronde (ou en étoile). En eau douce, la plupart des diatomées que vous verrez sont de type penné.
Dans les eaux marines, la variété des formes corporelles est beaucoup plus grande. Dans l’océan, elles forment la majeure partie du phytoplancton, les organismes photosynthétiques qui flottent avec le courant. Cette image montre la vue de dessus d’un grand Coscinodiscus , une espèce marine qui ne peut être vue à l’œil nu.

La fine structure en forme de filet de la paroi cellulaire siliceuse est clairement visible. Les chloroplastes jaune-brun utilisés pour la photosynthèse sont également faciles à voir (en lumière classique cf photo § précédent).
Comment observer des diatomées au microscope
La principale différence entre l’échantillonnage à partir de cultures et à partir d’échantillons de terrain est que, dans la plupart des cas, les cultures sont unialgales et la contamination est évidente. Cependant, parce que les diatomées sont omniprésentes et physiquement résistantes, le transfert croisé à partir de tubes de préparation ou même d’eau du robinet peut sérieusement compromettre la présence des espèces et les données d’abondance dans les échantillons de terrain. Par conséquent, toutes les mesures doivent être prises pour éviter la contamination. En termes de bonnes pratiques, ces étapes devraient également être appliquées à la préparation de diatomées à partir de cultures.
Milieu de montage diatomée
Plusieurs supports différents avec différents indices de réfraction (RI) sont disponibles pour monter les diatomées pour la microscopie optique, mais ceux avec un RI élevé sont généralement les meilleurs pour le montage des diatomées. Pour la plupart des diatomées, les supports à RI élevé offrent un plus grand contraste dans l’image microscopique et une meilleure profondeur de champ pour une ouverture numérique (NA) donnée. Un indice de réfraction général pour les diatomées est d’environ 1,43, elles seraient donc invisibles dans un milieu de cet indice.
Sécurité
Plusieurs produits chimiques différents sont disponibles pour éliminer la matière organique des diatomées et laisser le frustule de silicium intact. Nous utilisons du peroxyde d’hydrogène (H 2 O 2 ) qui est un agent oxydant puissant. Des gants en caoutchouc et des lunettes de protection doivent être utilisés lors de la manipulation et les déversements doivent être dilués avec de l’eau avant d’utiliser une serviette en papier pour absorber le déversement. Le toluène est un agent dangereux, c’est pourquoi il doit toujours être manipulé à l’intérieur d’une hotte aspirante, d’autant plus que la procédure consiste à faire barboter le toluène sur une plaque chauffante.
Pour la microscopie optique
Travaillez dans un environnement exempt de poussière et de courants d’air et assurez-vous que les lames et les lamelles sont propres avant le montage. Pour chaque échantillon, faire jusqu’à 3 lames ce qui permet un montage ou un archivage.
matériel : pipettes pasteur prébouchées, lames de verre, lamelles rondes diamètre 13 -19 mm, pinces, bac ou récipient de décantation, plaque chauffante.
- Placez jusqu’à 0,5 ml de suspension mélangée sur chaque lamelle, couvrez et laissez reposer jusqu’à deux jours car c’est le moyen le plus doux et le plus efficace d’obtenir une couverture uniforme des diatomées.
- Alternativement, les échantillons de lamelles couvre-objets peuvent être déposés pendant 15 à 30 minutes puis séchés plus rapidement à très basse température sur une plaque chauffante. Cela donne des lames de moindre qualité mais toujours acceptables pour une analyse qualitative). Notez qu’il s’agit d’une étape importante et contraire à la préparation normale des lames « humides », mais le séchage sur la lame conduit à de mauvais résultats car « la correction sphérique d’un objectif à NA élevé ne distingue pas sa tête de sa queue ».
- Chauffez une plaque chauffante dans une hotte aspirante à 130°
- Placer 1 goutte sur la lamelle avec les diatomées séchées sur la goutte.
- Chauffer la lame sur la plaque chauffante pendant 15 minutes pour chasser le toluène
- Laisser la lame refroidir et utiliser un doigt ou une pince pour s’assurer que la lamelle ne peut pas bouger, sinon la lame devra être chauffée plus longtemps.







Bonjour,
J’ai lu cet article avec intérêt.
Pour l’observation des diatomées, j’utilise le système d’éclairage µLight de la société leida Technologies qui permet de basculer du fond clair au fond noir ou au contraste de phase très simplement pour un prix raisonnable. Cela se monte sur tout modèle de microscope.
La société ardop Lighting commercialise ce dispositif en France
François